เซลล์อิเล็กโทรไลต์
เมื่อผ่านไฟฟ้าเข้าไปในเซลล์ที่ประกอบด้วยขั้วไฟฟ้าสองขั้วจุ่มอยู่ในสารละลายอิเล็กโทรไลต์ จะเกิดปฏิกิริยาเกิดขึ้นภายในเซลล์ เรียกกระบวนการนี้ว่า อิเล็กโทรลิซิส ( electrolysis ) และเรียกเซลล์ไฟฟ้าเคมีนี้ว่า เซลล์อิเล็กโทรไลต ์ ดังรูป 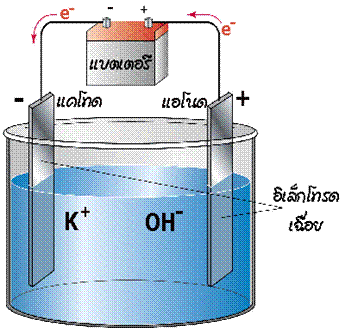
ในเมื่อแบตเตอรี่เป็นตัวจ่ายกระแสไฟฟ้า อิเล็กตรอนจะเคลื่อนที่ออกจากขั้วแอโนด (ขั้วลบ) ของแบตเตอรี่ผ่านลวดตัวนำไปยังขั้วไฟฟ้าของเซลล์อิเล็กโทรไลต์ ดังนั้นขั้วไฟฟ้าที่ต่อกับขั้วลบของแบตเตอรี่จะเป็นขั้วแคโทด เพราะเป็นขั้วที่เกิดปฏิกิริยารีดักชัน และเนื่องจากต่อกับขั้วลบ ขั้วไฟฟ้านี้จึงเป็นขั้วลบ ส่วนขั้วไฟฟ้าอีกขั้วหนึ่งเกิดปฏิกิริยาออกซิเดชันจึงเป็นขั้วแอโนด และต่อกับขั้วบวกของแบตเตอรี่จึงเป็นขั้วบวก อิเล็กตรอนเคลื่อนที่ออกจากขั้วแอโนดของเซลล์เข้าสู่แบตเตอรี่- เซลล์แกลแวนิก ขั้วที่เกิดออกซิเดชันมีอิเล็กตรอนสะสม(จากภายใน) จึงเป็นขั้วลบ
- เซลล์แกลแวนิก ขั้วที่เกิดรีดักชันมีอิเล็กตรอนสะสม(จากภายนอก) จึงเป็นขั้วลบ
ประโยชน์ของเซลล์อิเล็กโทรไลต์
การชุบโลหะ การชุบช้อนโลหะด้วยเงิน
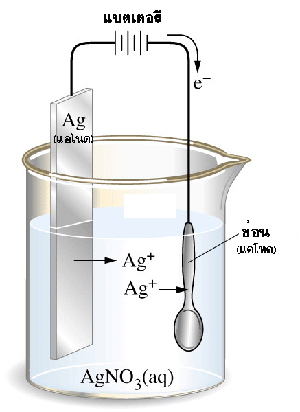 จากรูป การชุบช้อนโลหะด้วยเงิน ต้องใช้เงินเป็นแอโนด ช้อนโลหะเป็นแคโทด และใช้สารละลายซิลเวอร์ไนเตรตเป็นสารละลายอิเล็กโทรไลต์ ขั้วแอโนด: Ag: Ag(s) ขั้วแคโทด: ช้อน: Ag +(aq) + e - |

ไม่มีความคิดเห็น:
แสดงความคิดเห็น